Лечение рака прямой кишки
Лечение рака прямой кишки может быть чисто хирургическим, комбинированным и комплексным.
☘ Просмотреть стоимость услуг проктологии КОКБ в разделе «Цены».
При начальных стадиях рака прямой кишки (Т1-
Успех хирургического лечения, соблюдение его принципов в значительной степени зависит от правильной подготовки прямой кишки.
Существует несколько вариантов подготовки прямой кишки к операции:- Безшлаковая диета - рекомендуется приём специальных адаптированных смесей «Пептамен АФ» , Ресурс Оптимум
- Очистительные клизмы и прием слабительных
- Фортранс
- Гидроколонотерапия
- Передняя резекция прямой кишки с формированием ручного или аппаратного анастомоза;
- Низкая передняя резекция прямой кишки с формированием аппаратного анастомоза;
- Брюшно-
анальная резекция ( по Бебкоку - с формированием избытка низведенной кишки или по Свенсону – без избытка кишки, с формированием и вправленим анастомоза, по Иноятову – формированием плоской стомы); - Интерсфинктерная резекция (обычная или расширеная);
- Брюшно-
промежностная экстирпация с формирование классической или промежностной стом; - ТЭМ – трансанальное эндоскопическое микрохирургическое удаление опухоли.
Долгое время в онкопроктологии господствовало мнение, что наиболее радикальым вмешательством при раке прямойкишки любой локализации является экстерпация органа, подразумевающая не только удаление самой прямой кишки но и всех структур ее запирательного аппарата с выведением колостомы. Хирургические вмешательства при раке прямой кишки в последние два десятилетия претерпели существенные изменения. Это связано с особой функцией этого органа накапливать каловые массы и осуществлять произвольный акт дефекации с помощью сложного сфинктерного аппарата.
Еще недавно классическими хирургическими вмешательствами при раке прямой кишки были передняя резекция прямой кишки, при расположении опухоли в ректосигмоидном и частично в верхнеампулярном отделе прямой кишки, брюшно-анальная резекция, при расположении опухоли в верхнеампулярном и среднеампулярном отделах прямой кишки не ниже 6 см от наружного отверстия анального канала и брюшно-промежностная екстирпация прямой кишки при локализации опухоли в нижнеампулярном отделе прямой кишки с поражением сфинктера и анальном канале. Следует сказать, что мы, как и большинство авторов определяем в прямой кишке такие отделы и их границы: анальный канал – 3 см, нижнеампулярный отдел – 5 см, среднеампулярный отдел – 5 см, верхнеампулярный отдел – 5 см, ректосигмоидный отдел 3-4 см., всего - 21-22 см.
В последние годы, все больше внимания уделяется принципу функциональности при лечении рака средне-и нижне ампулярного отдела прямой кишки. Толчком к более широкому использованию новых хирургических вмешательств послужил ряд морфологических исследований дистальной границы резекции при раке нижнеампулярного отдела прямой кишки. Было установлено, что рост опухоли в дистальном направлении к сфинктеру, крайне незначителенпо сравнению с распространением в проксимальном и радиальном направлении и при умеренной дифференцировке клеток опухоли достаточно проводить дистальный край разреза в 1,5-2,0 см от края опухоли; с другой стороны,получило широкое развитие и распространение использования степлерных циркулярных сшивающих аппаратов,позволяющих накладывать анастомозы на те участки прямой кишки, где их ручное формирование невозможно ирасширять показания к низкой передней резекции прямой кишки в тех случаях, где ранее была показана брюшно-анальная резекция с низведением на промежность участка толстой кишки. При этом, чем ниже формируется такой степлерный анастомоз, тем большая вероятность его несостоятельности (при расстоянии 6 см от наружного края анального канала, или 1-3 см от зубчатой линии -15-20%). Для профилактики несостоятельности колоректальных степлерных анастомозов при низких передних резекциях предусматривается наложение временных протекторных (защищающих анастомоз) стом (илео-или трансверзо-), которые закрываются в среднем через 6 недель.
На сегодняшний день при расположении опухоли в анальном канале и нижнеампулярном отделе прямой кишки целесообразно выполнение брюшно-промежностной экстерпации прямой кишки с формированием забрюшинной плоской колостомы. Суть операции заключается в удалении прямой кишки вместе с замыкательным аппаратом, при этом полностью убирается параректальная клетчатка, пересекается мышца, поднимающая задний проход, и убирается клетчатка малого таза. В левой подвздошной области формируется забрюшинная плоская колостома. Лапаротомная и промежностная раны ушиваются наглухо.
При расположении опухоли на 7-10 см от края заднего прохода возможна брюшно-анальная резекция или низкая передняя резекция с аппаратным анастомозом.
Благодаря развитию хирургической техники и созданию нового поколения сшивающих аппаратов при этой локализации опухоли возможно выполнение низких передних резекций.
Трансанальная эндоскопическая микрохирургия (ТЭМ)
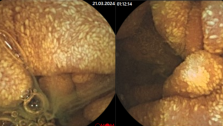
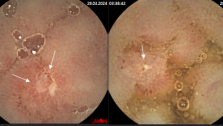
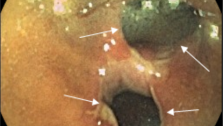
В последние годы, для лечения ранних стадий рака прямой кишки была предложена и внедрена в практику методика трансанальной эндоскопической микрохирургии (ТЭМ), позволяющая лечить опухолевые поражения со степенью инвазии опухолью стенки кишки Т1 – Т2 в нижнеампулярном отделе прямой кишки на высоте 12 см от зубчатой линии, отделяющей анальный канал от ампулы прямой кишки. Эта методика предусматривает наличие специального комплекса инструментов для ее проведения и не может быть использована без предварительного трансректального УЗИ прямой кишки, с помощью которого определяется степень инвазии опухолью стенки кишки и исключаются метастазы в регионарные лимфатические узлы. Использование ТЭМ без преувеличения является «прорывом» в лечении ранних стадий рака прямой кишки. При глубине инвазии опухолью кишечной стенки Т2, после выполнения ТЭМ показана адъювантная (послеоперационная) лучевая терапия.
Трансанальная эндоскопическая микрохирургия (ТЭМ) — это способ эндоскопического местного удаления новообразований прямой кишки через ее просвет с помощью специального инструментария, изобретенного профессором G.Buess (Германия) вначале 80-
Методика проведения ТЭМ-операций включает в себя следующее. В просвет прямой кишки вводится специальный аппарат — операционный проктоскоп, к которому присоединяются инструменты для раздувания кишки углекислым газом и освещения стенок кишки. Также к проктоскопу присоединяется видеокамера, которая выводит изображение на монитор, увеличивая его в 5 раз. Удаление опухоли проводится под контролем зрения с помощью специальных эндоскопических инструментов, которые также вводятся в операционный проктоскоп через рабочие каналы.
В сравнении с другими методиками ТЭМ-
- возможность точного иссечения опухоли в пределах любого слоя кишечной стенки, вплоть до иссечения на всю толщу кишки;
- доступность любого отдела прямой кишки;
- возможность остановки возникающего кровотечения разными методами (коагуляция, прошивание и др.);
- возможность удаления опухоли единым блоком с прилежащими тканями, что очень важно для информативного гистологического исследования удаленного полипа.
Классические методы лечения рака прямой кишки в 30-40% операций заканчиваются формированием колостомы (выведением толстой кишки на переднюю брюшную стенку). А такая операция как экстирпация прямой кишки (при низком расположении рака) является поворотным моментом в жизни пациентов, поскольку заканчивается формированием постоянной стомы и приводит к стойкой инвалидизации.
Учитывая вышесказанное, альтернативой традиционным методам оперативного лечения при ранних стадиях рака следует считать трансанальную эндоскопическую микрохирургию (ТЭМ).
Определяющими критериями к проведению ТЭМ-операции являются:
- Тis (начальная стадия рака), T1 (опухоль, прорастающая в подслизистый слой) и T2 (опухоль, прорастающая в мышечный слой);
- диаметр опухоли не больше 3 см;
- экзофитный рост опухоли (рост в просвет кишки);
- отсутствие язв и отечности слизистой оболочки в зоне основания опухоли;
- подвижность опухоли;
- размещение на высоте до 15 см от наружного анального отверстия;
- высокая степень гистологической дифференцировки опухоли.
Учитывая вышеуказанные критерии, проводится отбор пациентов для ТЭМ и в отделении проктологии Киевской областной клинической больницы.Пациенты нашего отделения проходят перед операцией всестороннее обследование, включающее все современные методики, которые позволяют оценить общее состояние больного, с высокой точностью определить стадию заболевания и выявить показания к ТЭМ-операции.
После обследования выполняется операция: трансанальное эндоскопическое микрохирургическое удаление опухоли прямой кишки (операционный проктоскоп фирмы Каrl Storz (Германия), адаптированный к стандартной лапароскопической стойке). Вмешательство выполняется под комбинированной анестезией: эндотрахеальный наркоз + перидуральная анестезия. Операция проводится по отработанной методике и включает в себя следующие этапы:- осмотр операционного поля;
- определение линии резекции, отступая на 1 см от основания опухоли;
- удаление опухоли в пределах здоровых тканей;
- ушивание раны в поперечном направлении.
Все больные, перенесшие в нашем отделении ТЭМ-операцию, выписаны из стационара в удовлетворительном состоянии. Проводится плановое наблюдение пациентов, стандартное их обследование.
Смотреть также видеофильм: ТЭМ удаление аденокарциномы (Т1) прямой кишки.
Тотальная мезоректумектомия (ТМЭ)
При полостных операциях на прямой кишке особое внимание уделяется правильности и тщательности удаления параретальной клетчатки, что связанно с тем, что именно микрометастазы находящиеся в ней являются основной причиной местных рецидивов рака прямой кишки. Этот принцип получил название тотальной мезоректумектомии (ТМЭ) и был обоснован Нeald and Ryall в 1982 и 1986 в годах в публикациях в «Британском журнале хирургии» и журнале «Ланцет». ТМЭ должна выполняться в переделах собственной фасции прямой кишки и без нарушения ее целостности, при этом дистальный уровень выделения клетчатки должен быть на 4 см дистальнее нижнего края опухоли. Выделение клетчатки производится исключительно острым путем с применением биполярних електрохирургических ножниц.
Одним из оперативных вмешательств, выполняемых при нижнеампуляном раке прямой кишки с поражением внутреннегосфинктера, направленном на частичное сохранение функции сфинктера, является интерсфинктерная резекция прямой кишки, предусматривающая удаление внутреннего и сохранение наружного сфинктера. В последние годывыделяют расширеную интерсфинктерную резекцию прямой кишки, предусматривающую удаление глубокой порциинаружного сфинктера.
С целью улучшения функциональности и повышения качества жизни больных предлагаются различные варианты хирургических пластик с формированием промежностных стом после экстирпаций прямой кишки. Нами применяется оригинальная методика экстирпации прямой кишки с проведением кололеватороглютеопластики, модулирование маноректального угла и формированием замыкательной «манжетки» из серозно-мышечного лоскута кишки иформированием промежностной стомы, которая позволяет улучшить качество жизни больных, особенно в молодом возрасте. Для восстановления резервуарной функции прямой кишки и предупреждения «синдрома низкой передней резекции», который заключается в многомоментном длительном и часто неполном опорожнении кишечника (до 6 раз в сутки) и ложных позывах на дефекацию, предлагаются различные виды тазовых резервуаров, сформированных из толстой кишки.
Следует также отметить, что современная хирургия рака прямой кишки предусматривает сохранение висцеральных нервных стволов иннервирующих область сфинктера и промежности.
Лапароскопические операции
Перспективным подходом к хирургическому лечению больных раком прямой кишки является применение малоинвазивных технологий, в частности – лапароскопических операций. Преимуществом таких вмешательств является уменьшение количества послеоперационных осложнений, снижение выраженности болевого синдрома и уменьшение потребности в наркотических анальгетиках, возможность ранней реабилитации больных. По предварительным данным большинства авторов отдаленные результаты лечения не уступают таковым после использования резекций прямой кишки выполненных с помощью лапаротомных доступов, однако следует отметить что до 40% лапароскопических вмешательств по поводу колоректального рака всетаки заканчиваются лапаротомным доступом.Для скорейшего восстановления работы кишечника после проведения операций по поводу рака прямой кишки, в раннем послеоперационном периоде (через 12 часов после оперативного вмешательства), а также при проведении неоадъювантной лучевой и химиотерапии рака прямой кишки рекомендуется применение энтерального питания специальными адаптированными лечебными смесями «Пептамен АФ» , Ресурс Оптимум.
Неоадъювантная лучевая и химиотерапия терапия при раке прямой кишки
С целью многофакторного воздействия на опухолевый процесс, антибластики за счет девитализации опухолевых клеток и уменьшения массы опухоли, создания благоприятного фона для последующего оперативного вмешательства существуют различные виды комбинированного и комплексного лечения рака прямой кишки.
Тактика лечения больных с резектабельными опухолями прямой кишки с критериями Т3-4 или любое Т и N1-2 скритерием М0 (стадии Т3-4N0-1-2M0) предусматривает проведение предоперационной лучевой терапии. Этот принцип,установленный еще в 70-80-е годы прошлого века, не изменился и в настоящее время. Опухоль является гетерогенной,то есть состоит из различных по своей пролиферативной активности групп клеток – пулов. Доказано, что отдельные опухолевые клетки попадая (имплантируясь) во время операции в ткани в операционном поле, способны выживать идавать начало новой опухоли – рецидиву. Смысл проведения лучевой терапии заключается в индуцировании гибели под действием облучения наиболее активных, находящихся в фазе митоза клеток, способных к имплантации во время операции, снижении репродуктивной активности остальных клеток. Лучевая терапия остается тем видом лечения,использование которого, позволяет в 2 раза снизить количество местных рецидивов рака прямой кишки, возникающих после хирургических операций, которые без ее проведения, составляют 15-30%. В странах Евросоюза, Российской Федерации, и странах СНГ используется предоперационная (неоадъювантная) интенсивная лучевая терапиясуммарной очаговой дозой 25 Гр. Европейские исследователи показали, что использование неоадъювантной лучевой терапии дозой 25 Гр уменьшает количество местных рецидивов с 27% до 12 %. В США стандартом лечения местно-распространенного рака прямой кишки, является послеоперационная лучевая терапия суммарной очаговой дозой 45 Гр в комбинации с химиотерапией 5-фторурацилом. Рандомизированные исследования показали, что применение такой схемы, позволяет уменьшить количество местных рецидивов рака прямой кишки с 24% при использовании только хирургического лечения, до 11 %. На Украине наиболее распространенным методом неоадъювантного воздействия на опухоль при резектабельном раке прямой кишки, является интенсивная дистанционная лучевая терапия суммарной очаговой дозой 25 Гр. Было показано, что данный режим, уменьшает количество местных рецидивов рака прямой кишки с 15,3% до 7,2% при отсутствии метастатического поражения лимфоузлов, и с 28,5% до 12,9% при метастатическом поражении лимфоузлов.
В ряде случаев опухоль прямой кишки является нерезектабельной из-за фиксации к стенкам таза, крестцу, инфильтрации опухолью подвздошных сосудов. В таком случае единственным методом лечения остается высокодозная лучевая терапия по расщепленной методике (суммарная доза облучения 45-60 Гр подводится к опухолевому очагу мелкими фракциями по 2 Гр). В последние годы подход к лечению таких больных несколько изменился. Приоритетным стало использование химио-лучевой терапии. Доказана её способность вызывать регрессию опухоли у большего количества больных по сравнению с лучевой терапией. Наиболее часто используемыми химиопрепаратами, являются 5-фторурацил, митомицин-С, кселода, препараты платины (цисплатин, карбоплатин, оксалиплатин). Химиопрепараты, кроме прямого воздействия на опухоль, выполняют роль радиомодификаторов за счет синхронизации клеточного цикла опухоли, а также блокируют процессы репарации в поврежденных лучевой терапией клетках опухоли.
Комбинированное лечение больных с использованием инвазивных методик: неоадъювантной эндолимфатической или внутриартериальной химиотерапии показали результаты сопоставимые с использованием лучевой терапии и не нашли широкого применения в комбинированном лечении рака прямой кишки.
Вместе с тем, при наличии критерия Т4 и метастатическом поражении лимфоузлов при любом Т (N1-2), рекомендуетсяпроведение адъювантной (дополнительной) химиотерапиичерез 3-5 недель после операции (всего 6 курсов синтервалом между ними 4-6 недель), целью которой является воздействие на микрометастатические комплексы,имеющиеся у таких больных. Еще до недавнего времени наиболее эффективными режимами адъювантой химиотерапиибольных с КРР являлись комбинации 5-фторурацила с лейковорином или левомизолом. В настоящее время, синтезнового препарата платины 3-го поколения оксалиплатина, привел к тому, что наиболее эффективной в адъювантномрежиме является схема химиотерапии FOLFOX-4 (5-фторурацил, лейковорин и оксалиплатин), о чем было доложенона 43-м ежегодном съезде Американской ассоциации онкологов (ASCO) в 2007 году. Однако наряду со схемойFOLFOX-4, комбинации 5-фторурацила с лейковорином и левомизолом являются схемами выбора для проведенияадъювантной химиотерапии. Для адъювантной химиотерапии в монорежиме может быть использован также препараткапецитабин (кселода), который очень удобен тем, что применяется только перорально. Всего используют 8двухнедельных циклов приема препарата с иинтервалом между циклами 1 неделя. В 2007 году была доказанаодинаковая эффективность схем FOLFOX-4 и ХЕLOX (кселода+оксалиплатин), которая также может быть использованадля ад’ювантного лечения. Эта схема химиотерапии очень удобна для больных, так как не предусматривает длительныхмногочасовых инфузий химиопрепаратов
Хирургическое лечение метастазов в печени при раке прямой кишки.
Достаточно сложным продолжает оставаться вопрос о лечении метастатического рака прямой кишки. Среди впервые выявленных больных 25% имеют отдаленные метастазы, а среди больных после радикального лечения они возникают в 50% случаев. Наиболее часто рак прямой кишки метастазирует в печень, затем в легкие и кости. Не вызывает сомнения приоритетность хирургического лечения единичных метастазов рака прямой кишки в печень и легкие.Хирургическое лечение метастазов в печени может быть одномоментным (одновременное удаление первичной опухоли и метастазов в печени) и двухмоментным (сначала удаление первичной опухоли, а через 2-3 месяца – удаление метастазов в печени). Широкому внедрению хирургического метода лечения метастазов в печень в практику способствовало развитие новых технологий разделения тканей печени с помощью ультразвукового деструктора-аспиратора, гармоничного скалпеля и др., а также технологий остановки паренхиматозного кровотечения с помощьюаргоно-плазменного коагулятора, тахокомба. Для уменьшения объема опухолевых образований может быть использована неоадъювантная химиотерапия (по схемам FOLFOX, FOLFIRI). Следует считать доказанным, что комбинация хирургического лечения с использованием неоадъювантных и адъювантных курсов химиотерапии приводит к улучшению без рецидивной выживаемости по сравнению с чисто хирургическим лечением и должна быть рекомендована для лечения таких больных.
При локализации единичного метастатического очага в периферических отделах печени, расположенных нарасстоянии от ворот печени и нижней полой вены выполняются атипичные и сегментарные резекции печени. При наличии монолобарного множественного поражения печени выполняются лево-или правосторонние гемигепатэктомии. После проведения гемигепатэктомии, единичные очаги, расположенные в остающейся доле печени могут быть объектом для последующей адъювантной химиотерапии или радиочастотной абляции или криодеструкции. Современное развитие хирургии позволяет выполнять резекции печени в самых анатомически труднодоступных сегментах, а развитие сосудистой хирургии, позволяет резецировать стенку нижней полой вены при вростании в нее опухоли. Однако такие операции возможны только в специализированных центрах печеночной хирургии при наличии достаточного опыта и специализированного медицинского персонала. Одновременное удаление первичной опухоли и метастазов рака прямой кишки в печень обеспечивает 5-летнюю выживаемость в 15-25%. Резекции печени по поводу отдаленных метастазов, которые развились в период наблюдения за больными после радикальных операций,позволяют добиться 5-летней выживаемости в пределах от 25 до 45%. Послеоперационная летальность при этом составляет 3-9%.
Наличие вне печёночных метастазов (например, в пара аортальные лимфоузлы), а также множественные билобарные поражения печени метастазами, являются противопоказанием для хирургического лечения и предусматривают проведение химиотерапии, криодеструкции. Резекции легких показаны при единичных метастазах рака прямой кишки и приводят к 5-летней выживаемости 35-48%. Развитие мало инвазивных торакоскопических методик часто позволяет при этом избежать торакотомий.
Циторедуктивная хирургия
В последние годы, в связи с появлением новых, более эффективных противоопухолевых препаратов (оксалиплатин,иринотекан, кселода, авастин, эрбитукс), появилось понятие циторедуктивной хирургии, которое применимо и кбольным с метастазами рака прямой кишки и предполагает максимально возможное удаление метастатических узлов споследующим проведением химиотерапии.
При наличии единичных метастазов в печени больших размеров с прорастанием в нижнюю полую вену, при высоком риске оперативного вмешательства, связанном с наличием сопутствующей патологии, показано проведение криогенной деструкции, которая дает хорошие результаты, сопоставимые с хирургическим лечением, но является безопасным,бескровным, хорошо переносимым методом лечения. Современная криохирургическая аппаратура представалена универсальной установкой „Крио-Пульс” с набором оригинальных криоапликаторов. Нашими учеными впервые предложен и с успехом используется метод лапароскопической криодеструкции метастатических опухолей в печени.
При нерезектабельных множественных метастазах рака прямой кишки в печень, а также в печень и легкие, печень и почку, печень и парааортальные забрюшинные лимфоузлы, показана системная химиотерапия по схеме FOLFOX или(XELOX), при прогрессировании заболевания больные переводятся на схему FOLFIRI (5-фторурацил, лейковорин,иринотекан). В качестве препарата монотерапии может быть использован препарат кселода, отличительной особенностью которого является активизация препарата в клетках опухолевой ткани. Этот препарат может приниматься в амбулаторных условиях под наблюдением онколога. Возможен прием фторафура. При исчерпанных возможностях вышеуказанных схем, в качестве препарата 2-й и 3-й линии химиотерапии используется авастин(бевацизумаб), моноклональное антитело, блокирующее фактор роста эндотелия сосудов. Этот препарат не являясьцитостатиком, блокирует процессы ангиогенеза, роста опухоли и ее метастазирование. Наиболее перспективными являются не монотерапия авастином, а его комбинации с оксалиплатином, иринотеканом и кселодой. Используется также моноклональное антитело к эпидермальному фактору роста – цетуксисмаб (эрбитукс). Он применяется в комбинации с химиотерапией по схемам FOLFOX, FOLFIRI, XELOX. Обязательным условием его применения является интактный статус гена к-RAS. Если этот ген мутирован, терапия эрбитуксом будет неэффективной.
Современные схемы химиотерапии метастатического рака прямой кишки позволяют достичь медианы выживаемости 22 месяца, в то время когда использование схем химиотерапии, основанных на 5-фторурациле до 1998 года позволяло достичь медианы выживаемости 11,7 месяцев.
Перспективным методом выбора в лечении больных с множественными метастазами рака прямой кишки в печень,является внутри артериальная химиотерапия с использованием 5-фторурацила, препаратов платины, адриабластина. Ее применение позволяет достичь регрессии опухоли и обеспечить медиану выживаемости в 24 месяца.
Одной из проблем, возникающих после хирургического и комбинированного лечения больных с раком прямой кишки,являются локальные рецидивы. При раке прямой кишки локальные рецидивы составляют от 5 до 35%. Основнымметодом лечения таких больных является хирургический метод. Операции по поводу местных рецидивов сложны,часто сопровождаются кровотечениями из вен таза и радикальны только у каждого 5 больного.
В половине случаев рецидивные опухоли являются нерезектабельными, и до недавнего времени единственнымметодом их лечения была лучевая терапия, эффективная лишь в половине случаев, позволяющая достичь медианывыживаемости 12 месяцев. Существенно (в 1,5 раза) повышает эффективность лучевой терапии прием кселоды илифторафура в качестве ее модификаторов.
Послеоперационный прогноз при раке прямой кишки
Прогноз при раке прямой кишки зависит от стадии опухолевого процесса. В начальных стадиях заболевания(ІА стадия, Т1 N0M0). 5-летняя выживаемость после радикальних операций может достигать 90%. Однако с увеличением стадии заболевания результаты значительно ухудшаются. У больных с поражением лимфатических узлов 5-летняя выживаемость составляет не более 50%. Отдаленные результаты операций по поводу рака прямой кишки несколько хуже. В среднем 5-летняя выживаемость пациентов, перенесших радикальные операции, составляет 50%, при этом также прослеживается зависимость отдаленных результатов от стадии процесса.
Необходимо регулярно обследовать лиц, оперированных по поводу колоректального рака, поскольку в дальнейшем у них возможно появление рецидива заболевания и отдаленных метастазов. Нельзя ограничиваться только опросом иосмотром явившихся с какими-либо жалобами больных, так как на ранних стадиях рецидив рака прямой кишки может никак себя не проявлять. Необходимо проводить осмотр каждые 3 мес. с использованием пальцевого исследования,ректоромано-, колоно-или ирригоскопии оставшихся отделов прямой кишки, 1 раз в 6 мес.-ультразвуковое исследование печени, брюшной полости и малого таза, рентгенография грудной клетки. Из лабораторных анализов может быть полезным определение уровня раково-эмбрионального антигена. При подозрении на рецидив для более точной диагностики необходима компьютерная или магнитно-резонансная томография.85% местных рецидивов в течении первых 2-х лет после операции, а средний срок появления рецидивов равен 13 мес. При своевременном обнаружении рецидивов и метастазов у 1/3 больных можно выполнить их хирургическое удаление. Остальным пациентам, к сожалению, приходится рекомендовать паллиативное лечение (лучевое ихимиотерапию), которое несколько облегчает их положение.В нашей клинике выполняются все оперативные вмешательства по поводу колоректального рака, комбинированные операции, резекции печени, операции по поводу рецидивов рака прямой кишки, тазовых забрюшинных опухолей.Предпочтение отдается низким и сверхнизким передним резекциям с аппаратными степлерными анастомозами. Лечение проводится согласно стандартам с использованием лучевой и химиотерапии.
Читайте также: Лечение рака ободочной кишки.